Théorie cinétique des gaz
Martin Aubé Ó
12 janvier 2004
|
Département de géographie et télédétection |
Département de physique |
|---|---|
|
Université de Sherbrooke |
Collège de Sherbrooke |
L'ensemble de la thermodynamique repose sur l'idée qu'un système peut être caractérisé par un ensemble limité de variables macroscopiques (température (T), pression (P), concentration (N)). Cette idée s'appuie sur l'hypothèse que toutes les particules composant le fluide sont identiques. Toutefois cette idée et donc la thermodynamique n'est valide que lorsque le système est dit en équilibre thermodynamique. C'est-à-dire que ces variables sont uniformes et constantes dans le volume considéré. La thermodynamique est très puissante puisqu'elle permet de décrire simplement le comportement de systèmes extrêmement complexes.
Pour bien comprendre l'origine de cette théorie ainsi que la signification des variables macroscopiques il convient de passer à l'échelle microscopique. Nous considérerons le cas d'un gaz parfait constitué d'un très grand nombre de particules identiques. Remarquez que le terme « particule » est ici très large puisque cette théorie peut être utilisée pour décrire le comportement des étoiles à l'intérieur d'une galaxie et dans ce cas les particules sont des étoiles (typiquement 10 000 000 fois plus massives que la terre!). Dans l'application qui nous intéresse nous pensons plutôt à des molécules et ce cas est évidemment plus simple puisque nous pouvons négliger la contribution de la force de gravité à l'énergie des particules (c.-à-d. le potentiel gravitationnel est essentiellement le même pour toutes les molécules). Dans ce cas, l'énergie d'une particule est dominée par l'énergie cinétique. Comme la géométrie de la molécule est dans un premier temps considérée sphérique, nous nous permettrons de négliger l'énergie de rotation ou de vibration. Nous discuterons plus loin de l'impact de ces processus sur la description microscopique de tels systèmes.
Nous supposons que le volume V contient N molécules ce qui permet de définir la concentration du gaz:
![]() .
(1)
.
(1)
Chaque
particule est complètement caractérisée par sa
position et sa vitesse (direction et grandeur). Toutefois suivant une
approche statistique nous pouvons aussi concevoir qu'en considérant
l'ensemble des particules nous pouvons définir une vitesse
moyenne![]() .
Comme cette vitesse est définie dans un espace 3D nous
pouvons montrer à partir du théorème de
Pythagore que
.
Comme cette vitesse est définie dans un espace 3D nous
pouvons montrer à partir du théorème de
Pythagore que
![]() (2)
(2)
Si
nous supposons le système isotrope
![]() ,
alors
,
alors
![]() .
(3)
.
(3)
Nous tenterons en premier lieux d'exprimer le concept de pression d'un point de vue microscopique. Supposons qu'une particule se déplaçant sur l'axe des x frappe de façon élastique une surface parallèle au plan y-z (voir figure ci-dessous).
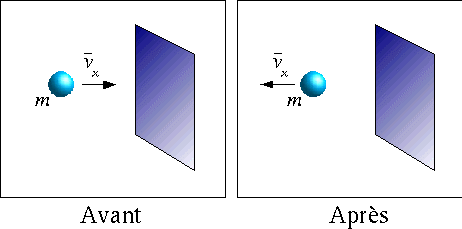
Figure 1: Quantité de mouvement d'une particule avant et après une collision élastique avec une surface perpendiculaire.
Avant
la collision la particule possède une quantité de
mouvement de
![]() alors
qu'après la collision la quantité de mouvement de cette
même particule devient
alors
qu'après la collision la quantité de mouvement de cette
même particule devient![]() .
Ce qui signifie que la particule a subie une variation de quantité
de mouvement
.
Ce qui signifie que la particule a subie une variation de quantité
de mouvement
![]() .
En d'autre terme, la variation de quantité de mouvement par
unité de particule est donné par
.
En d'autre terme, la variation de quantité de mouvement par
unité de particule est donné par
![]() (4)
(4)
Comme la quantité de mouvement doit être conservée, la surface doit absorber exactement la même quantité de mouvement en direction opposée.
Vous avez déjà vu que selon la 2e loi de Newton,
![]() .
(5)
.
(5)
Cette équation peut être exprimée de façon plus générale comme
![]() (6)
(6)
En utilisant la notion de différentielle totale et en ne retenant que la composante selon x, nous pouvons écrire:
![]() (7)
(7)
Mais
le nombre de collision par unité de temps est simplement donné
par le produit de la concentration avec le volume formé par le
déplacement des particules à la vitesse
![]() .
Comme les particules doivent faire le trajet aller-retour, il faut
toutefois diviser ce nombre par 2.
.
Comme les particules doivent faire le trajet aller-retour, il faut
toutefois diviser ce nombre par 2.

Figure 2: Volume balayé par un mouvement à vitesse constante pendant un temps infinitésimal dt.
Soit![]() alors
nous pouvons déterminer le nombre de collisions par unité
de temps comme suit:
alors
nous pouvons déterminer le nombre de collisions par unité
de temps comme suit:
![]() (8)
(8)
Et donc la force exercée sur la surface A est donnée par
![]() (9)
(9)
Par définition la pression est la force par unité de surface
![]() .
(10)
.
(10)
En utilisant l'équation 3, nous pouvons réécrire cette équation en fonction de la vitesse quadratique moyenne:
![]() ,
(11)
,
(11)
que nous pouvons exprimer en fonction de l'énergie cinétique moyenne puisque
![]() (12)
(12)
d'où
![]() (13)
(13)
Équation que nous pouvons réarranger comme suit
![]() (14)
(14)
Pour
un gaz parfait, nous pouvons combiner l'équation d'état![]() avec
l'équation 14 afin de mettre en relation la température
et l'énergie cinétique moyenne.
avec
l'équation 14 afin de mettre en relation la température
et l'énergie cinétique moyenne.
![]() soit
soit
![]() (15)
(15)
Nous pouvons aussi relier la vitesse quadratique moyenne à la température
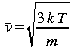 (16)
(16)
Ce
système possède 3 degrés de liberté![]() ou
3 paramètres indépendants qui permettent de déterminer
son énergie totale (vx, vy,
vz). En fait le théorème de
l'équipartition de l'énergie propose d'associer une
quantité d'énergie
ou
3 paramètres indépendants qui permettent de déterminer
son énergie totale (vx, vy,
vz). En fait le théorème de
l'équipartition de l'énergie propose d'associer une
quantité d'énergie![]() à
chaque degré de liberté d'un système. Pour un
molécule diatomique, nous devons ajouter en principe 3 autres
degrés de liberté soit les trois vitesses de rotation
perpendiculaires mais si nous prenons en considération que la
taille des atomes est très petite devant la distance
inter-atomique, nous comprenons que la rotation de la molécule
autour de son axe principal contribue de façon négligeable
à l'énergie de rotation. Ce système possède
donc 5 degrés de liberté actifs. L'énergie
moyenne d'une molécule diatomique est donc donnée par
à
chaque degré de liberté d'un système. Pour un
molécule diatomique, nous devons ajouter en principe 3 autres
degrés de liberté soit les trois vitesses de rotation
perpendiculaires mais si nous prenons en considération que la
taille des atomes est très petite devant la distance
inter-atomique, nous comprenons que la rotation de la molécule
autour de son axe principal contribue de façon négligeable
à l'énergie de rotation. Ce système possède
donc 5 degrés de liberté actifs. L'énergie
moyenne d'une molécule diatomique est donc donnée par
![]() .
(17)
.
(17)
Une
telle molécule peut aussi entrer en vibration il faut alors
ajouter deux autre degrés de liberté puisque nous
devons tenir compte de l'énergie cinétique de vibration
et de l'énergie potentielle de liaison. Toutefois ces deux
degrés de libertés ne deviennent actifs que lorsque
![]() .
Il s'agit de la limite de cette théorie (voir figure 3). Pour
une explication plus élégante de tels systèmes
il faut faire appel à la théorie quantique.
.
Il s'agit de la limite de cette théorie (voir figure 3). Pour
une explication plus élégante de tels systèmes
il faut faire appel à la théorie quantique.
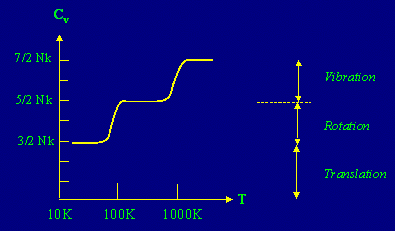
Figure
3: Évolution de la valeur de la chaleur spécifique en
fonction de la température pour la molécule H2.
N.B.
![]()
Nous avons déterminé la valeur de la vitesse quadratique moyenne mais n'avons pas donné d'information sur la distribution des vitesses ou si vous préférez sur la probabilité de rencontrer une vitesse donnée à l'intérieur du fluide. Maxwell et Boltzmann ont trouvé une réponse à cette question. En particulier, Boltzmann montra que dans un système en équilibre thermique à la température T, la probabilité pour qu'une particule possède une énergie mécanique E est donné par le facteur de Boltzmann
![]() (18)
(18)
Pour
un gaz parfait, l'énergie est dominée par l'énergie
cinétique![]() .
.
Toutefois
plusieurs vecteurs de vitesse différents peuvent conduire à
la même valeur d'énergie cinétique (c.-à-d.
même norme du vecteur vitesse). On dit alors que le niveau
d'énergie est dégénéré. En fait
pour bien saisir le concept de dégénérescence,
imaginez que l'on forme un espace tridimensionnel qui défini
l'ensemble des valeurs possibles de![]() .
Les bases de cet espace sont des vecteurs unitaires orientés
selon vx, vy et vz.
Imaginons que l'on divise cet espace en petits cubes de largeur dvx
, dvy et dvz. Chaque cube
correspond alors à un état de vitesse unique et possède
un volume
.
Les bases de cet espace sont des vecteurs unitaires orientés
selon vx, vy et vz.
Imaginons que l'on divise cet espace en petits cubes de largeur dvx
, dvy et dvz. Chaque cube
correspond alors à un état de vitesse unique et possède
un volume![]() .
Dans cet espace, nous pouvons déterminer le nombre de cubes
qui permettent de caractériser un système de vitesse
comprise entre v et v+dv. Nous supposons ici
que
.
Dans cet espace, nous pouvons déterminer le nombre de cubes
qui permettent de caractériser un système de vitesse
comprise entre v et v+dv. Nous supposons ici
que![]() .
Dans l'espace des vitesses, cette gamme des vitesses possibles
définit une coquille sphérique de largeur dv et
de rayon v. Le volume de cette coquille étant donnée
par
.
Dans l'espace des vitesses, cette gamme des vitesses possibles
définit une coquille sphérique de largeur dv et
de rayon v. Le volume de cette coquille étant donnée
par
![]() ,
(19)
,
(19)
le
nombre de cubes contenus dans la coquille est donc proportionnel à![]() ,
ce qui veut dire que le nombre d'états dégénérés
est proportionnel à
,
ce qui veut dire que le nombre d'états dégénérés
est proportionnel à![]() .
.
Nous
en arrivons à définir la probabilité
![]() qu'une particule possède une vitesse comprise entre v
et v+dv. Cette probabilité est bien entendu
proportionnelle au nombre d'états possibles et donc
qu'une particule possède une vitesse comprise entre v
et v+dv. Cette probabilité est bien entendu
proportionnelle au nombre d'états possibles et donc
![]() .
(20)
.
(20)
Comme une particule a 100% de probabilité de posséder une vitesse quelconque,
![]() (21)
(21)
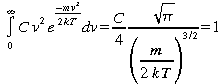 (22)
(22)
En d'autre termes
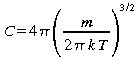 .
(23)
.
(23)
Ce qui nous conduit à la distribution de Maxwell-Boltzmann
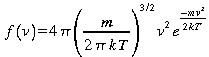 .
(24)
.
(24)
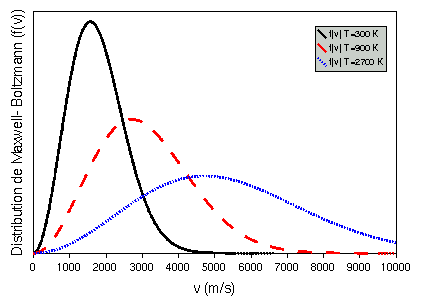
Figure 4: Distributions de Maxwell-Boltzmann pour 3 températures et pour une particule de m=10-20 kg.